Minitab und FDA
- Erstellt am 5.6.2018
- Überarbeitet am 11.4.2024
- Software: Minitab 22, 21, 20, 19, 18, 17...
Ist das Programm für diesen Standard für Medizinprodukte oder Pharmazeutika validiert? Wie sieht es insbesondere mit CFR Title 21 - Part 11 aus?
Dieser Artikel basiert hauptsächlich auf den beiden Artikeln des Herstellers,
Ist Ihre Statistiksoftware von der FDA für Pharmaprodukte validiert?
und
Minitab and Compliance with CFR Title 21 – Part 11 - ID 2588
die wir hier für Sie übersetzt habe. Zusätzlich haben wir Informationen über die Validierungsressourcen ergänzt, die die ADDITIVE GmbH anbietet.
Erläuterung
Der Hersteller führt umfangreiche Tests zum Zweck der internen Validierung des Programms Minitab durch. Minitab ist aber nicht Out-of-the-Box gemäß FDA validiert, weil Software-Anbieter keinen Zertifizierungsprozess für eine FDA-Softwarevaldidierung absolvieren können. Gemäß dem FDA-Code of Federal Regulations Titel 21 Teil 820.70 (i) ist das Validieren der Software für den Verwendungszweck Aufgabe des Softwarekäufers (in der Produktion oder im Rahmen eines Qualitätssicherungssystems):
Wenn Computer oder automatisierte Datenverarbeitungssysteme im Rahmen der Produktion oder eines Qualitätssystems eingesetzt werden, muss der Hersteller die Computersoftware im Hinblick auf die vorgesehene Verwendung gemäß einem festgelegten Protokoll validieren. Alle Änderungen an der Software müssen vor der Genehmigung und Veröffentlichung validiert werden. Die Maßnahmen und Ergebnisse der Validierung müssen dokumentiert werden.
Zusätzliche unterstützende Information für Medizingerätehersteller finden Sie in Abschnitt 6 der Validation of Automated Process Equipment and Quality System Software in den Principles of Software Validation; Final Guidance for Industry:
Der Gerätehersteller ist dafür verantwortlich sicherzustellen, dass die vom OTS-Softwareentwickler (Off the shelf, Standardsoftware) eingesetzten Verfahren für die Produktentwicklung geeignet und ausreichend für die vorgesehene Nutzung der OTS-Software durch den Gerätehersteller sind. Für OTS-Software und -Geräte kann der Gerätehersteller Zugang zur Dokumentation der Software-Validierung durch den Hersteller haben, dies ist aber nicht immer der Fall. Wenn der Hersteller Informationen zu den Systemanforderungen, Softwareanforderungen, Validierungsverfahren und Ergebnissen der Validierung vorlegen kann, kann der Medizintechnikproduzent diese Informationen aus Ausgangspunkt für die benötigte Validierungsdokumentation nutzen.
Verwendungszweck
Es gibt gute Gründe für eine Anleitung für den Verwendungszweck. Hier ist ein Beispiel:
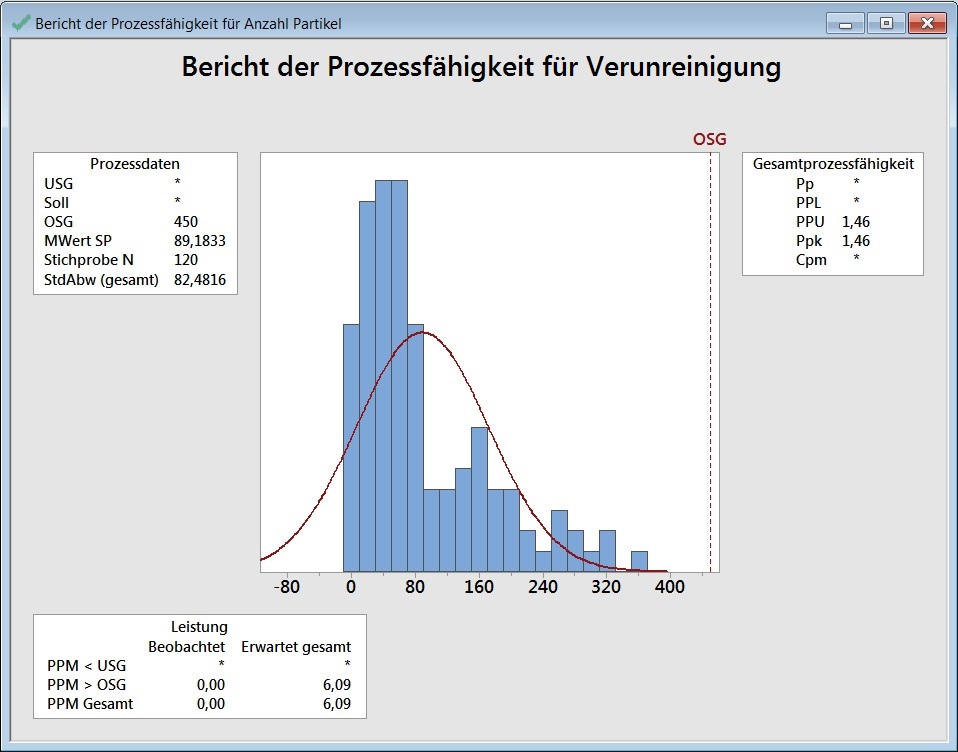
Unternehmen XYZ nutzt Minitab, um die Wahrscheinlichkeit eines Defekts in einem Herstellungsprozess abzuschätzen. Wenn die Verunreinigung 450 mg / ml übersteigt, gilt das Produkt als defekt. Angenommen, Sie möchten mit Minitab eine Prozessfähigkeitsanalyse (Normal) durchführen. Die erste Grafik zeigt zwei für die meisten Standards ziemlich gute Werte: Einen Ppk-Wert von 1,46 und eine Fehlerquote von ungefähr 6 ppm. Auf Grundlage dieser Zahlen könnte der Hersteller jetzt fälschlicherweise von einem guten Prozess ausgehen.
Tatsächlich hat Minitab hier keine falschen Berechnungen gemacht. Da die Daten nicht normalverteilt sind, ist die Prozessfähigkeitsanalyse für normalverteilte Daten aber das falsche Verfahren. Mit der Prozessfähigkeitsanalyse (Normal) ist die Software nicht für die Prozessfähigkeitsanalysen für nicht normalverteilte Daten validiert.
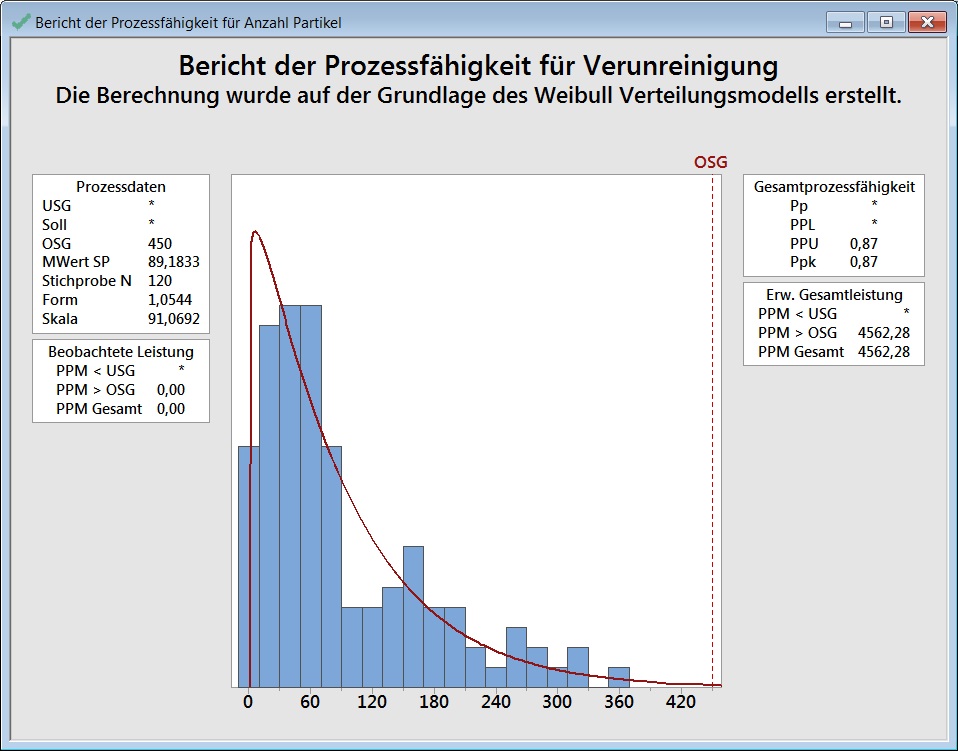
Hierfür gibt es in Minitab ein Werkzeug zum Durchführen einer Prozessfähigkeitsanalyse für nicht normalverteilte Daten. Wenn Sie Prozessfähigkeitsanalyse (Nicht normal) aufrufen und eine passende Verteilung auswählen, in diesem Beispiel die Weibullverteilung, dann werden zwei schlechtere Werte ausgegeben: Ppk-Wert von 0,87 und eine Fehlerquote von 4562 ppm:
Was muss validiert werden?
Softwarepakete für die Prozessüberwachung und zur Bestimmung des Qualitätsniveaus sollten validiert werden. Zur Validierung von Minitab müssen Sie den Verwendungszweck dokumentieren. Dazu bilden Sie jede Anforderung an die Software auf einen oder mehrere Testfälle ab. Ein Abschlussprüfer kann feststellen, dass ein System nicht validiert wurde, wenn eine Anforderung ohne Testfall entdeckt wird.
Sie können eine Traceability Matrix verwenden, um Ihre Anforderungen und Testfälle zu verfolgen.
Ein Testfall sollte sich auf den folgenden Bestandteilen zusammensetzen:
- Eine Testfallbeschreibung. Beispiel: Validieren einer Prozessfähigkeitsanalyse für nicht normalverteilte Daten.
- Schritte zur Ausführung. Beispiel: Wählen Sie Statistik: Qualitätswerkzeuge: Prozessfähigkeitsanalyse aus dem Minitab-Hauptmenü. Geben Sie die Spalte mit den Prozessdaten ein und wählen Sie die entsprechende Verteilung aus.
- Testergebnisse (mit Screenshots).
- Eine Entscheidung, ob die Software den Test bestanden hat oder nicht.
- Unterschrift des Prüfers mit Datum.
Warnschreiben im Hinblick auf Software-Validierungen
Das Verletzen dieser Regelung ist Gegenstand vieler Warnschreiben an Produzenten. Einige Beispiele finden Sie im Artikel des Herstellers:
Ist Ihre Statistiksoftware von der FDA für Pharmaprodukte validiert?
Validierungsressourcen des Herstellers und der ADDITIVE GmbH
Es liegt in der Verantwortung des Softwarekäufers, Software für den vorgesehenen Gebrauch zu validieren. Wenn Sie Minitab einsetzen, bietet der Hersteller Ressourcen, um Ihnen bei der als Softwarekäufer in Ihrer Verantwortung liegender Validierung für den Verwendungszweck zu helfen. Hier können Sie das Software-Validierungs-Kit von Minitab herunterladen:
Dieses Software-Validierungs-Kit wurde erstellt, um Ihnen zu helfen zu verstehen, wie wir die Minitab Statistical Software für die Marktreife validieren und das fortgesetzte Engagement von Minitab für Qualität bestätigen.
Für unsere Kunden, die mit uns einen ADDITIVE Professional Support-Vertrag abgeschlossen haben, bieten wir außerdem einen Leitfaden zur Software-Validierung mit einigen weiteren Fallbeispielen aus der Literatur.
Wenn Sie an einem Projekt zur Unterstützung beim Erstellen eines unternehmensspezifischen Validierungskit interessiert sind,
Minitab und Einhaltung von CFR Titel 21 - Teil 11
Eine häufige Frage von Minitab-Kunden aus der Industrie ist die Einhaltung der FDA-Verordnung über elektronische Aufzeichnungen und elektronische Signaturen (21 CFR Part 11) mit der Software Minitab. Wir möchten unsere Kunden unterstützen unsere Produkte gemäß den Richtlinien aller Regulierungsbehörden, einschließlich der FDA, zu nutzen.
Die Statistiksoftware Minitab bietet Passwortschutz zum Öffnen, Speichern und Ändern von Projektdateien. Dieser Schutz dient als elektronische Signatur zur Validierung der laufenden Nutzung und Speicherung von Minitab-Projektdateien. Für die vollständige Kontrolle sollte der Passwortschutz mit einem Datei- oder Quellcodeverwaltungssystem kombiniert werden, um Datum, Uhrzeit und genehmigten Zugriff zu überprüfen. Minitab bietet auch eine Skriptsprache, die zusammen mit validierter Ausgabe archiviert werden kann. Das Skript und die Ausgabe können als Teil einer passwortgeschützten Projektdatei gespeichert werden. Zum Verschlüsseln eines Minitab-Projekts mit einem Passwort siehe auch:
Wie kann ich ein Minitab-Projekt mit einem Passwort absichern?
Das Ausmaß, in dem ein reguliertes Unternehmen die FDA-Anforderungen erfüllt, hängt nicht ausschließlich davon ab, ob die Software Minitab konform ist, sondern wie das regulierte Unternehmen Minitab als Werkzeug in seiner Forschung und Datenanalyse einsetzt. So wie unsere Kunden für die Validierung ihrer Prozesse und Systeme mit Minitab verantwortlich sind, sind sie letztlich auch für die Einhaltung der Richtlinien für elektronische Aufzeichnungen und elektronische Signaturen verantwortlich. Mit anderen Worten, die Verwendung von Minitab allein macht die Benutzer nicht mit dieser Regelung konform. Die Bereitstellung von Audit Trails und eine sichere Aufbewahrung erfordert ein System, das alle Komponenten erfüllt, die in den Regeln des Titels 21 und insbesondere in Teil 11 der Richtlinie beschrieben sind.
Siehe auch
CFR - Code of Federal Regulations Title 21 (Part 11)
|
|