Verwendung einer benutzerdefinierten App zur Charakterisierung von Kalziumtransienten in patienteneigenen Kardiomyozyten
Cara Hawey, Hébert Lab, Department of Pharmacology and Therapeutics, McGill University, Montréal, Quebec
Cara Hawey ist derzeit Masterstudentin im Labor von Dr. Terry Hébert, Abteilung für Pharmakologie und Therapeutik, McGill University in Montréal, Quebec. Ihr Forschungsschwerpunkt ist die Verwendung von Kardiomyozyten aus induzierten pluripotenten Stammzellen (iPSC-CMs) von Patienten zur Charakterisierung von dilatativen Kardiomyopathien.
Stammzellen sind im Zusammenhang mit der Entwicklung von Embryonen weithin bekannt. Stammzellen können jedoch auch mit Hilfe von erwachsenen Menschen gewonnen werden. Zellen aus z. B. Haut oder Blut können einer Person entnommen und genetisch zu Stammzellen umprogrammiert werden, die sich dann in jeden beliebigen Zelltyp verwandeln können. Diese Zellen werden als induzierte pluripotente Stammzellen (iPS-Zellen) bezeichnet. iPS-Zellen (abgekürzt auch iPSC) sind ein leistungsfähiges Instrument für die personalisierte Krankheitsmodellierung und können zur Entwicklung von "Krankheitsmodellen in der Petrischale" verwendet werden. Durch die Umwandlung von iPS-Zellen in Kardiomyozyten können einfache Modelle von Herzerkrankungen entwickelt werden. Kardiomyozyten sind spezialisierte Zellen innerhalb des Herzmuskels, die für die kontraktile Funktion des Herzens verantwortlich sind. Im Rahmen dieser Forschung werden von Patienten stammende Kardiomyozyten verwendet, um dilatative Kardiomyopathien (DCM) zu untersuchen, eine Gruppe von Krankheiten, die zu einer gestörten Kontraktionsfähigkeit des Herzmuskels führen. Cara untersucht insbesondere, wie die Dysregulation von Kalzium bei der Krankheit eine Rolle spielen kann und wie sie mit der gestörten Kontraktilität zusammenhängt.
Caras Forschung generiert große Datenmengen, und sie hatte festgestellt, dass ihre Analysearbeit sehr zeitaufwändig war. Daraufhin nahm sie mit OriginLab Kontakt auf, weil sie ihre Analysen automatisieren und ihren Arbeitsablauf leichter handhabbar machen wollte. Sie erläuterte zunächst ihr Problem: "Ich verwende einen genetisch kodierten Fluoreszenz-Biosensor, um Kalziumtransienten von Kardiomyozyten auf Einzelzellebene zu verfolgen. Ich extrahiere die Fluoreszenzdaten aus TIFF-Stapeln, um Parameter wie den Tau-Abfall, die Zeit bis zum Peak, die Amplitude und die Wellendauer zu messen. Derzeit verwende ich Excel-basierte Methoden zur Datenanalyse, würde aber gerne eine zeitsparendere und einfachere Methode zur Erfassung von Kalziumtransienten entwickeln.“ Ausgehend von Beispieldatensätzen hat Dr. Yiming Chen von der OriginLab-Gruppe für technischen Support und Anwendungsentwicklung mit Cara zusammengearbeitet, um eine maßgeschneiderte Anwendung zu entwickeln, die ihren Anforderungen entspricht.
OriginLab hat Cara gebeten, ein wenig über die Mechanismen ihrer Forschung zu erzählen und wie sie die benutzerdefinierte Anwendung „Transientenanalyse“ zur Analyse ihrer Daten verwendet:
"Um Kalziumtransienten in iPSC- Kardiomyozyten auf Einzelzellebene zu überwachen, verwende ich einen genetisch kodierten Fluoreszenz-Biosensor namens RGECO-TnT, der sich am Myofilament lokalisiert [1]. Das Myofilament ist die kontraktile Einheit des Kardiomyozyten und beherbergt den Troponin-Komplex. Kalzium bindet den Troponin-Komplex, um die Kontraktionen der Kardiomyozyten auszulösen. Das fluoreszierende Protein RGECO wurde an ein Mitglied des Troponin-Komplexes gebunden, um RGECO-TnT zu bilden. RGECO-TnT ist ein intensiometrischer Biosensor, der als Reaktion auf die Kalziumbindung an den Troponin-Komplex fluoresziert. Dieser Biosensor kann zur Überwachung der Kalziumverarbeitung auf Myofilamentebene in einzelnen Zellen verwendet werden."
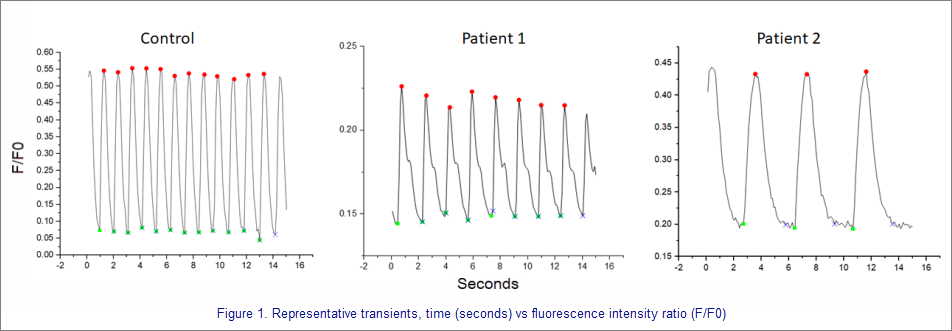
Repräsentative Transienten, Zeit (Sekunden) gegen Fluoreszenzintensitätsverhältnis (F/F0)
"Die Daten können mit Hilfe von Fluoreszenzmikroskopen, wie dem Mikroskoptyp „Zeiss Axio Observer Fully Automated Inverted“, erfasst werden. Die iPSC-Kardiomyozyten von Patienten mit DCM sowie von gesunden Kontrollpersonen werden auf schwarzwandige 96-Well-Platten mit optischen Böden plattiert. Die Zellen werden in einer gas- und temperaturkontrollierten Kammer am Mikroskop aufbewahrt. Mit einem roten Fluoreszenzfilter und einem 20fach-Objektiv werden Bildstapel von spontanen Kalziumtransienten für eine Dauer von 15 Sekunden aufgenommen."
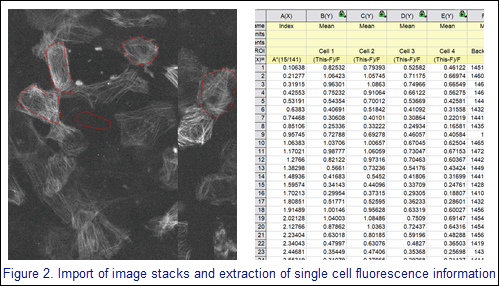
Sobald die Bildstapel erstellt sind, importiert Cara die Multi-Frame-Bilder in Origin-Matrizen. Anschließend wählt sie mit dem Hilfsmittel "Regionale Datenauswahl" einzelne Zellen sowie die Hintergrundfluoreszenz der Probe aus und markiert sie. Die Intensitätsdaten werden für alle ROI-Felder der Matrix extrahiert, und die Zellfluoreszenz wird auf die Hintergrundfluoreszenz normalisiert. Die Frame-Nummer wird in eine Zeit innerhalb der 15-Sekunden-Sequenz umgewandelt.
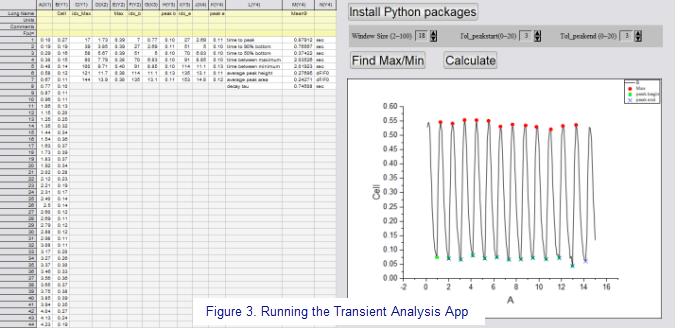
"Die App zur Analyse von Kalziumtransienten "Calcium Transient Analysis" (zusammen mit OriginLab entwickelt) wird dann ausgeführt, um die Merkmale der Kalziumtransienten zu bestimmen, einschließlich der Zeit bis zum Peak, der Zeit bis zu 50 % der Basislinie, der Zeit bis zur 90 % der Basislinie, der Zeit zwischen Maximum, Dauer des Transienten, Peakhöhe und Fläche unter der Kurve. Die monoexponentielle Kurvenanpassung wird zur Bestimmung des tau-Abfalls verwendet. Diese Merkmale werden für jeden einzelnen Peak bestimmt und gemittelt, um einen Wert pro Zelle zu erhalten. Die Ergebnisse für jede Zelle in einem Bildstapel werden in einer Spalte des Arbeitsblatts zusammengefasst. Diese Merkmale werden verwendet, um Patienten mit Patienten sowie Patienten mit Kontrollpersonen zu vergleichen, um festzustellen, wie Kalzium am Myofilament dysreguliert ist. Dieser Test kann auch verwendet werden, um festzustellen, wie die Kalziumverarbeitung im Laufe der Zeit als Reaktion auf einen chronischen Insult gestört werden kann."
"Die App Calcium Transient Analysis bietet einen sehr benutzerfreundlichen und unkomplizierten Ansatz zur grafischen Darstellung der Daten und statischen Analyse."
Cara fügt hinzu, dass die App Calcium Transient Analysis eine Anpassung der Fenstergröße ermöglicht, um die Anzahl der Peaks besser bestimmen zu können. Peakanfang und Peakende können bei Bedarf angepasst werden, um den Anfang und das Ende der Peaks ggf. genauer zu bestimmen. „Nach jeder Anpassung suche ich Max./Min. und führe ich 'Berechnen' aus, sobald die Peaks genau identifiziert sind. Die Registerkarte 'Zusammenfassung' wird aktualisiert und die Ergebnisse für die Zellen werden zusammengestellt, um entsprechende Vergleiche anstellen zu können (z. B. Patient vs. Kontrollperson, Patient über die Zeit als Reaktion auf eine chronische Behandlung).“ Cara verwendet dann OriginLabs App Paired Comparisons Plot, um die Gruppen grafisch zu vergleichen und die Ergebnisse zu vervollständigen.
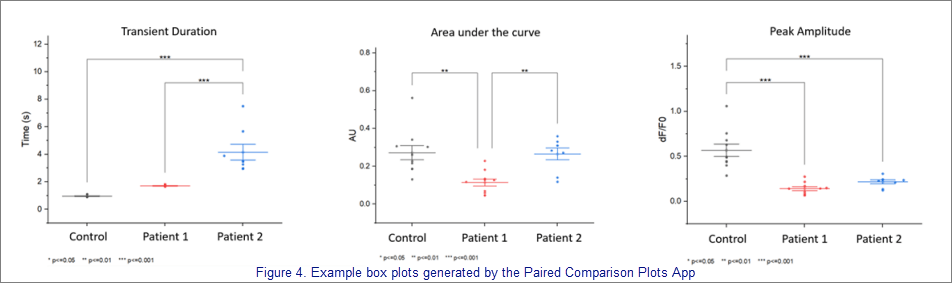 Beispiel für Boxplots, die mit der App Paired Comparison Plots erstellt wurden.
Beispiel für Boxplots, die mit der App Paired Comparison Plots erstellt wurden.
Cara erzählt uns, dass sie plant, die benutzerdefinierte App Calcium Transient Analysis für ihre gesamte Kalziumanalyse zu verwenden. „Weitere Anwendungen dieses Assays können potenzielle Therapeutika untersuchen und Assoziationen zwischen der Kalziumverarbeitung und anderen Merkmalen herstellen, die Krankheiten zugrunde liegen, wie z. B. dysregulierte Signalwege und Phänotypen wie gestörte Kontraktilität oder desorganisierte Sarkomere.“
Darüber hinaus erwartet sie, dass auch andere in ihrem Labor die App als nützlich empfinden werden. „Die App Calcium Transient Analysis kann verwendet werden, um beliebige Transienten wie spannungsbezogene Transienten zu analysieren, um elektrophysiologische Eigenschaften von iPSC-Kardiomyozyten zu verfolgen, die von DCM-Patienten und gesunden Kontrollpersonen stammen.“
[1] Measurement of Myofilament-Localized Calcium Dynamics in Adult Cardiomyocytes and the Effect of Hypertrophic Cardiomyopathy Mutations https://pubmed.ncbi.nlm.nih.gov/30732532/
Originaltext: OriginLab Corp., User Case Studies: Using a Custom App to Characterize Calcium Transients in Patient-derived Cardiomyocytes